近日(rì),我校王建浩、蔣鵬舉的納米生物醫學團隊與蘇(sū)州大學李永(yǒng)強團隊合作在《Small》上發表題為“A nanoFlare-based strategy for in situ tumor margin demarcation and neoadjuvant gene/photothermal therapy”的封底論(lùn)文(Small, 2018, 14, 1802745;Back Cover),王(wáng)建浩副教(jiāo)授為該論文的共同(tóng)第一作者。《Small》由Wiley-VCH集團出版,位列頂級(jí)多學科期刊行列 (中科院一(yī)區TOP期(qī)刊,影響因子為9.598),所(suǒ)發表的有關納米和微尺度的研究涵蓋(gài)了(le)材料科學、化學、物理(lǐ)學、工(gōng)程學、醫學和生物學(xué)等多個領域。(通(tōng)訊員/任濤 編輯/莊媛)
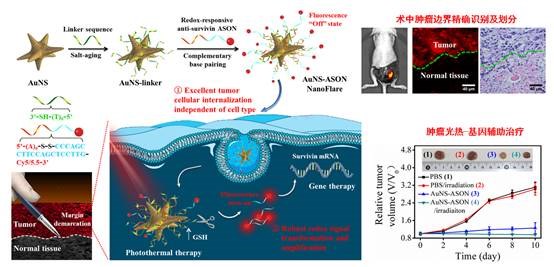

附:惡性腫(zhǒng)瘤是人類死亡原因中的第二大原因,目前手術切除是(shì)主要治療方式。然而由於腫瘤組織的浸潤性和不規則(zé)性,對腫瘤組織的準確識(shí)別和劃分一直是目前臨床腫瘤手術中的難點,從而往往導致術後(hòu)腫(zhǒng)瘤的高複發(fā)和(hé)高轉移。因此,對惡性腫(zhǒng)瘤的邊界精準區分是保證腫瘤治療效率(lǜ)的重要前提條件。
納米耀斑(Nanoflares)是一種具有金納米顆粒核心和單鏈熒光標記DNA層修飾的納米探針(zhēn),其(qí)表麵三維(wéi)的DNA修飾層使其具有(yǒu)極強的細胞膜穿透和幹擾胞內核酸分子轉錄和翻譯的特性,在腫瘤細(xì)胞的識別和殺滅方麵得到了廣泛關注。基於NanoFlare的概念(niàn),並利用癌細胞內存在的高濃度穀胱甘肽,本(běn)工作合成了金納米星顆粒,並(bìng)在其表麵高效負載插入有二硫鍵的survivin反義寡核苷酸分(fèn)子(Cy5.5標記),構建了具有(yǒu)穀胱甘肽特異性響應的NanoFlare探針(AuNS-ASON)。該探針本身由於發生熒光共振能量轉移處於熒光淬(cuì)滅狀態,但是它(tā)可以快速穿過(guò)細胞(bāo)膜(mó),從(cóng)溶酶體(tǐ)中逃逸出來,並在遇到(dào)腫瘤細胞中高濃度穀胱甘肽的激活(huó)後發生熒光恢複,成功實現了(le)對小鼠模型術中不(bú)同類型腫瘤邊界的準確區分。此外(wài),基於金(jīn)納米星優異的光熱特性以及survivin反義寡核苷酸分子對腫瘤高效的基因治療作用(yòng),NanoFlares探針在對腫瘤邊(biān)界進行準確區分的同時,還實現了對其的高效光熱-基因協同治療。該工作充分利用了NanoFlares在熒光激活成像和基因治療方麵(miàn)的潛力,同時利用腫瘤組織內含有(yǒu)的高濃度穀胱甘肽,有望為腫瘤的精確診斷和高效治療提供一種新思路和新手段。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/smll.201870245
|
關(guān)閉窗口
打印文檔(dàng)
|